
トップ > 研究用素材
研究用素材
Fucoxanthin
フコキサンチン研究・フコキサンチン商品開発を素材から支えたい
純度90%以上の藻類由来フコキサンチンを
最新型培養装置により安定供給
► フコキサンチンとは
自然界には750種類以上もの多種多様なカロテノイドが存在しています。地球上におけるカロテノイドの生産に主に携わっているのは光合成生物です。なぜなら、カロテノイドが光合成の最初の過程であり非常に重要な光捕集を担い、さらに、光合成の過程で発生を避けられない活性酸素を除去するという一人二役を担うことが出来るからです。その生産量も膨大で年間1億トン以上と言われています。
フコキサンチンは、主に昆布・ひじき・ワカメなどの褐藻類の葉緑体に存在するカロテノイドでキサントフィルに属します。フコキサンチンという名前は、褐藻(=フコ)に存在するキサントフィル(=キサンチン)から付けられたものです。陸上で栽培される緑黄色野菜に存在するβ‐カロテンやリコペンが健康に良い成分としてよく知られていますが、海洋に広く分布する海藻類に含まれるフコキサンチンはそれらよりも圧倒的に存在量は多く、カロテノイドの中で一番を誇ります。なのに未だよく知られていないのは、欧米では褐藻類を食する習慣がなく、研究するにも、図1に示すように、アレン構造、エポキシドおよびヒドロキシル基を有する複雑奇異な構造のため化学合成が困難で、天然からの抽出分離も含有量が非常に少ないため困難であることが理由でした。しかし、近年、日本人研究者によりフコキサンチンの抗肥満および抗糖尿病作用が報告され、日本発カロテノイドとして非常に注目されてきています。
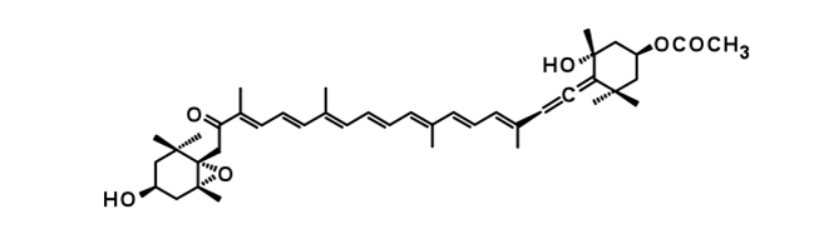
図1
► フコキサンチンの機能性
フコキサンチンの機能としては、抗酸化作用、抗炎症作用、抗がん作用、血管新生抑制作用などが報告されていますが、ここでは、食品素材として重要で他のカロテノイドにはない非常にユニークなメカニズムによる抗肥満および抗糖尿病作用について紹介します。
<抗糖尿病作用1-3)>
ワカメから抽出分離精製したフコキサンチン0.2%含有飼料を5週齢の糖尿病/肥満マウス(KK-Ay)に4週間経口投与したところ、その体重増加が抑制されました(図2(A))。一方、健常マウス(C57BL/6J)の体重には影響しませんでした。大変興味深いことに、フコキサンチン投与により白色脂肪組織(WAT)の重量がコントロール群と比べて減少していました(図2(B))。
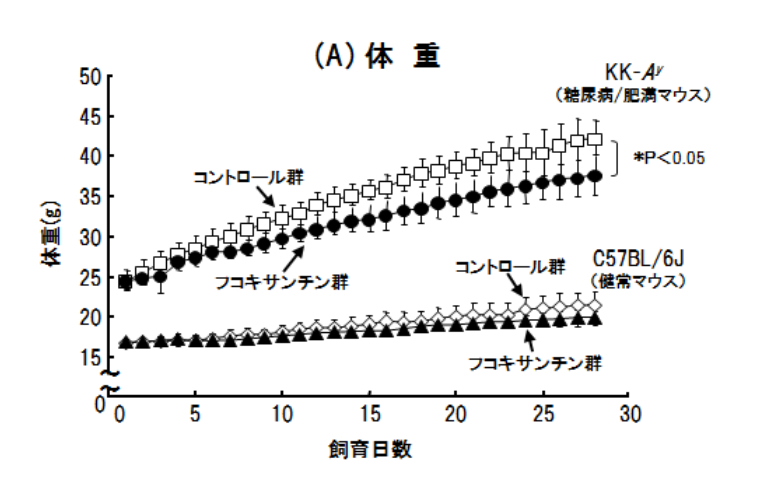
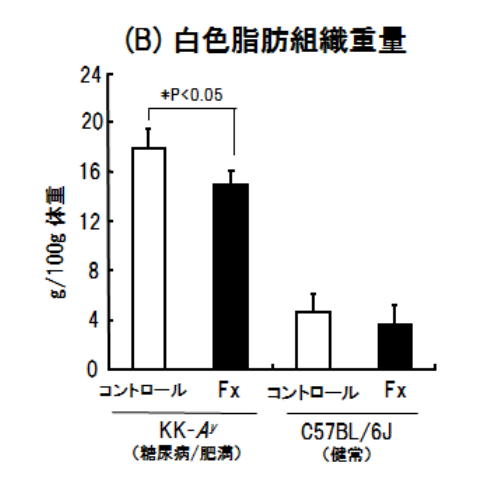
図2.フコキサンチン0.2%含有飼料を4週間経口投与したマウスの体重の推移(A)と総白色脂肪組織重量(B)
フコキサンチンが抗肥満作用を発揮する作用メカニズムは、WAT中でのミトコンドリアタンパク質である脱共役タンパク質1(uncoupling protein 1, UCP1)の発現が誘導されたためだと考えられています。UCP1は、通常、褐色脂肪組織に高発現して脂肪酸を熱へと変換するタンパク質であり、WATでの発現量は極めて低いとされています。フコキサンチンは、このUCP1を白色脂肪組織において発現誘導することができるのです。これによって、WATをはじめ生体でのエネルギー代謝が亢進し、抗肥満作用を発現することと考えられています。この作用メカニズムは他のカロテノイドにはなく非常にユニークでフコキサンチンの最も特徴的な機能性です。
臨床試験においてもフコキサンチンの抗肥満作用が報告されています。フコキサンチンを2.4 mg含む海藻脂質を16週間摂取することによって、ヒトでの体脂肪の減少とエネルギー代謝の亢進が確認されました。
<抗糖尿病作用1,4,5)>
フコキサンチン0.1%および0.2%含有飼料を糖尿病/肥満マウス(KK-Ay)に4週間投与したところ、図3のような血糖値の改善が認められています(図3)。また、高脂肪食によって食事性肥満を誘導したマウスでも血糖値の低下が確認されています。この作用メカニズムは、インスリン抵抗性を惹起させ糖尿病発症の原因となるTNF-αやIL-6のmRNA発現を白色脂肪組織(WAT)において抑制することであるとわかっています。更に、生体内において最大のエネルギー消費器官である骨格筋組織において、フコキサンチンは糖取り込み機能を担うグルコーストランスポーター4(GLUT4)を活性化したと報告されています。
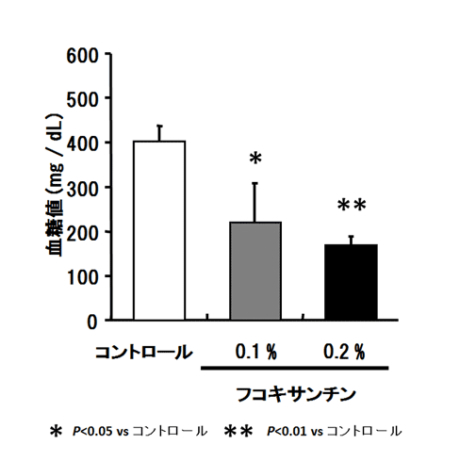
図3.フコキサンチン0.1%および0.2%含有飼料を4週間経口投与した糖尿病/肥満マウス(KK-Ay)の血糖値
► フコキサンチンの代謝,6,7)
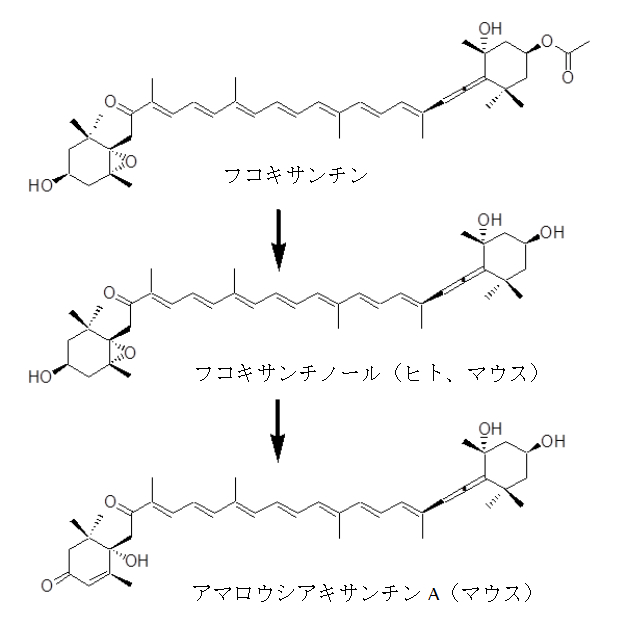
前述の機能性はフコキサンチンがそのまま生体に吸収されて発揮されるのではなく、その代謝物がそれらの効果を発揮していることがわかっています。マウスにフコキサンチンを経口投与した場合には、生体内ではフコキサンチンは検出されずアセチル基が脱離したフコキサンチノールとその酸化物であるアマロウシアキサンチンAが検出されます。ところが、ヒトに31 mgのフコキサンチン含有コンブ抽出物を単回投与した場合では、血漿中においてフコキサンチノールは検出されますがアマロウシアキサンチンAは検出されていません。
► フコキサンチンの今後
今後、フコキサンチン高含有微細藻類の大量培養が低コストで可能となれば、臨床試験がなされ、安全性や機能性が確認されてブレークスルーが起きると十分に考えられます。
参考文献:
1) Hosokawa M, Miyashita T, Nishikawa S, Emi S, Tsukui T, Beppu F, Okada T, Miyashita K. Fucoxanthin regulates adipocytokine mRNA expression in white adipose tissue of diabetic/obese KK-Ay mice. Arch Biochem Biophys. 504(1):17-25 (2010).
2) Maeda H, Hosokawa M, Sashima T, Funayama K, Miyashita K. Fucoxanthin from edible seaweed, Undaria pinnatifida, shows antiobesity effect through UCP1 expression in white adipose tissues. Biochem Biophys Res Commun. 332(2): 392-7 (2005).
3) Abidov M, Ramazanov Z, Seifulla R, Grachev S. The effects of Xanthigen in the weight management of obese premenopausal women with non-alcoholic fatty liver disease and normal liver fat. Diabetes Obes Metab. 12(1):72-81 (2010).
4) Woo MN, Jeon SM, Kim HJ, Lee MK, Shin SK, Shin YC, Park YB, Choi MS. Fucoxanthin supplementation improves plasma and hepatic lipid metabolism and blood glucose concentration in high-fat fed C57BL/6N mice. Chem Biol Interact. 186(3):316-22 (2010).
5) Nishikawa S, Hosokawa M, Miyashita K. Fucoxanthin promotes translocation and induction of glucose transporter 4 in skeletal muscles of diabetic/obese KK-A(y) mice. Phytomedicine. 19(5):389-94 (2012).
6) Asai A, Sugawara T, Ono H, Nagao A. Biotransformation of fucoxanthinol into amarouciaxanthin A in mice and HepG2 cells: formation and cytotoxicity of fucoxanthin metabolites. Drug Metab Dispos. 32(2):205-11 (2004).
7) Hashimoto T, Ozaki Y, Taminato M, Das SK, Mizuno M, Yoshimura K, Maoka T, Kanazawa K. The distribution and accumulation of fucoxanthin and its metabolites after oral administration in mice. Br J Nutr. 102(2):242-8 (2009).

